【科普】 | 氧气,有强大的辅助抗癌潜力——一文了解高压氧疗法
2024-08-02 13:31
【科普】 | 氧气,有强大的辅助抗癌潜力——一文了解高压氧疗法
文章来源:转载自公众号归野拾光
作者:归野拾光
(转载仅作科普,如有侵权请联系删除)
高压氧疗法(HBOT)是一种医疗技术,将患者置入特制的高压氧舱“内,在高于海平面的气压下(压力通常在1.4~3个大气压之间),让患者吸入百分之百的氧气,从而提高体内氧气含量,改善组织的缺氧情况,提高免疫力及促进伤口愈合。这样的治疗效果,常规氧气疗法无法做到。

1 高压氧为什么能改善体内缺氧
氧气在血液中的运输主要依靠两种形式:一是与血红蛋白结合的形式,即氧合血红蛋白;二是直接溶解在血浆中的形式,称为物理溶解氧。其中前者是氧气在血液中的主要运输方式。在正常大气压条件下,几乎近97%的氧气通过氧合血红蛋白输送到不同的组织与器官。高压氧的施用对通过红细胞的氧气输送没有太大的影响,但是可以增加血液中的氧气溶解量,从而增强组织氧合(组织氧合指的是组织获得和利用氧气的过程)。研究证明,高氧环境可以加速受损组织的愈合和再生,增加胶原蛋白的生成减少体内炎症;可以抑制某些厌氧菌的生长,增强免疫系统的功能
因此,高压氧被用于治疗各种病理状态,其在缺血和再灌注损伤治疗中的有益作用已经得到充分证实。高压氧还被广泛用于辅助治疗或改善与缺氧有关的疾病,包括脑部疾病(如脑梗塞、脑供血不足、脑出血、一氧化碳中毒产生的迟发性脑病)、心血管疾病(如冠心病、心肌梗死、心源性休克)以及消化系统疾病(如急慢性胃炎、十二指肠炎和肝功能障碍)。
2 缺氧与癌症
一个常见的误解是,肿瘤组织由癌细胞和正常细胞组成。但是,现实远比这个复杂。肿瘤组织这个癌细胞赖以生存的土壤即肿瘤微环境里不仅有癌细胞,还有肿瘤相关成纤维细胞和血管内皮细胞等基质细胞、T细胞等免疫细胞及其分泌因子、血管及细胞外基质(包括胶原蛋白、蛋白多糖、生长因子、蛋白酶以及黏附分子等)等。
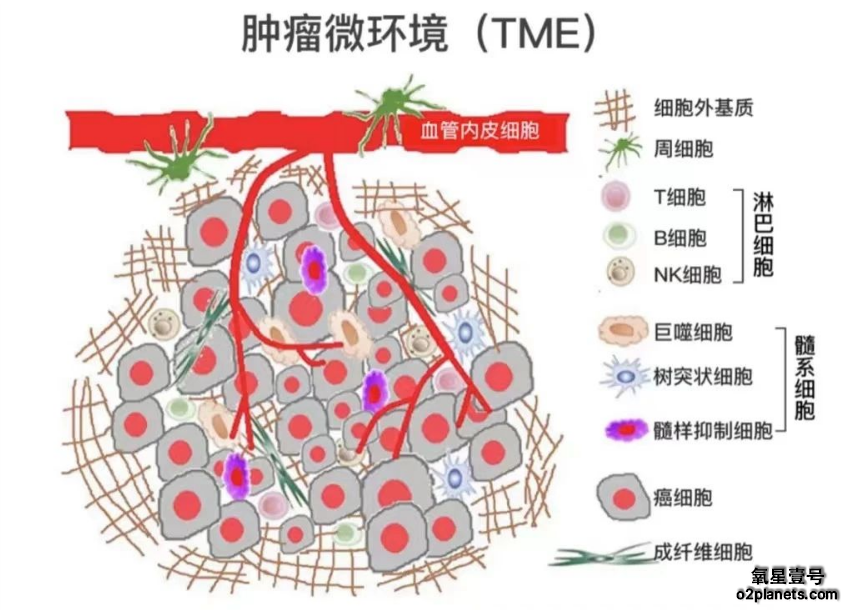
肿瘤微环境有着不同于人体正常环境的特点其中缺氧是肿瘤微环境的主要特点之一。研究已经证明,缺氧环境会诱导癌症生长、增加糖酵解(糖酵解是癌细胞产能的主要方式。更多信息请参考本公众号《癌症·探索:癌症是如何发生的》一文)和基因不稳定性从而增加癌症的侵袭性、降低对放化疗等常规治疗的敏感度中
关于癌症的发病机制即癌症是如何发生的,存在着不同的理论,包括癌症基因理论、癌症代谢理论和干细胞理论等。目前,作为主流理论,癌症基因理论认为,癌基因和抑癌基因的突变是癌症的主要成因。不过,癌症基因理论并没有“一统天下”,而且,近年来越来越多的研究对癌症基因理论提出了质疑。
癌症代谢理论认为,癌症是代谢疾病,其主要原因是氧缺乏以及由糖酵解产能替代了正常细胞的有氧呼吸(更多信息请参考本公众号《癌症·探索:癌症是如何发生的》一文)。当细胞的有氧呼吸被糖酵解替代,这种代谢异常会造成基因不稳定与基因突变,伴随着关键基因突变,进而形成癌症
尽管还没有“一统天下”的癌症发病理论,但有一点几乎是确定的,那就是细胞缺氧是癌症形成的重要原因,同时肿瘤血管结构和功能异常又进一步加剧肿瘤微环境的缺氧状态,诱导癌症的生长和侵袭,
因此,人们开始研究高压氧作为常规治疗或康复的辅助治疗手段用于癌症治疗的潜在价值。
3 高压氧疗法与癌症治疗
大量研究证明,高压氧疗法能够提高血浆中的氧浓度增加肿瘤微环境中的氧含量,可以为肿瘤治疗提供更多的临床益处。这些益处包括
①抑制肿瘤生长;
②增强癌细胞对放、化疗等癌症治疗手段的敏感性,从而加强治疗效果;
③减少放化疗的副作用(如骨髓抑制、白细胞减少、放射性脑病、脊髓病、骨坏死等);
④改善术后愈合,减少术后并发症;
研究也指出,单独使用高压氧疗法的疗效有限。更多时候,高压氧疗法作为辅助治疗手段,联合其他治疗方法,如常规的放化疗、光动力疗法(关于光动力疗法的更多信息,请参考本公众号《什么是光动力疗法(PDT)》一文)、温热疗法(更多信息,请参考本公众号《什么是温热疗法》一文)以及生酮饮食等。
在一项针对脑胶质瘤的研究中,接受放疗联合高压氧疗法的患者的中位生存期为38周,而对照组(常压下进行放疗的患者)为31周,18个月后的生存率分别为28%和10%。一项覆盖320名宫颈癌患者的临床试验显示,放疗联合高压氧治疗组的局部肿瘤控制率和生存率均明显高于对照组
2017年,国际医学期刊《Cureus°》报告了一例乳腺癌患者完全缓解的病例。患者(29岁)于2016年10月确诊为三阴性乳腺癌,分期为T4N3M1,伴有淋巴结、肝脏和腹腔转移。随后,患者接受了高压氧疗法联合代谢支持化疗、生酮饮食、温热疗法的综合治疗方案。2017年2月的全身PET-CT°扫描显示没有任何异常的FDG代谢,原发灶和转移灶完全消失。之后,患者继续接受该治疗方案,并于2017年4月进行了乳房切除术,手术结果与PET-CT结果一致,在切除的乳房组织中未发现任何癌细胞残留。
代谢支持化疗是一种基于癌症代谢理论的新型化疗应用方法 。在实践中,代谢支持化疗包括从前一天晚上开始禁食 12 小时和在化疗前注射药物剂量的常规胰岛素降低血糖a,以提高化疗疗效。
在一项纳入24例I-IV期局部晚期或转移性胃腺癌“患者的小规模回顾性研究中,接受代谢支持化疗、生酮饮食、温热疗法和高压氧疗法的综合治疗后,22名患者(88%)获得完全缓解(完全缓解是指肿瘤经治疗后在影像学上完全消失)。该研究显示了综合治疗(代谢支持化疗生酮饮食、温热疗法和高压氧疗法)在治疗晚期胃癌方面的巨大潜力。
总之,作为辅助治疗手段,高压氧疗法在肿瘤治疗中显示出多种潜在益处。但高压氧疗法并非适用于所有癌症患者,其辅助治疗疗效因肿瘤类型、恶性程度、患者的临床状态而异,并取决于氧合方案的细节(应用时机,持续时间和压力等)。进行高压氧疗法前需要专业评估,并在专业医疗人员的指导下进行治疗。
主要参考文献:
01 MoenlStuhr LEB.Hyperbaric oxygen therapy andcancer-a reviewJ.Targeted oncology,2012,7:233-242
02 Watson ER,Hainan KE,Dische S,et al. Hyperbaricoxygen and radiotherapy: a Medical Research Council trial incarcinoma of the cervix[J]. The British Journal of Radiology1978,51(611):879-887.
03 Stepie± K,Ostrowski R P, Matyja E.Hyperbaric oxygen asan adjunctive therapy in treatment of malignancies, includingbrain tumours[Jl.Medical Oncology, 2016,33: 1-9.
04 CadelS,McEwen JB, Dische S, et al. Hyperbaric oxygenand radiotherapy:aMedical Research Council trialincarcinoma of the bladder[J]. The British Journal of Radiology1978,51(611):876-878.
05 Poff A M, Ward N, Seyfried T N, et al. Non-toxic metabolicmanagement of metastatic cancerinVMmice:novecombination of ketogenic diet, ketone supplementation, andhyperbaricoxygentherapy[J.PloS one,2015,10(6):e0127407.
06 Chen S Y,Tsuneyama K, Yen M H, et al. Hyperbaric oxygensuppressed tumor progression through the improvement oftumor hypoxia and induction of tumor apoptosis in A549-cell-transferred lung cancery.Scientific reports,2021,11(1)12033.


